Karbonskābju funkcionālie atvasinājumi.
Sāļi
| Sāļi veidojas, ja karbonskābes karboksilgrupas ūdeņraža jonu aizvieto ar metāla jonu. | 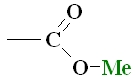 |
Karbonskābju sāļiem biežāk lieto vēsturiskos nosaukumus. Veidojot sāļu nosaukumus pēc IUPAC nomenklatūras, to nosaukumi beidzas ar izskaņu –oāts.
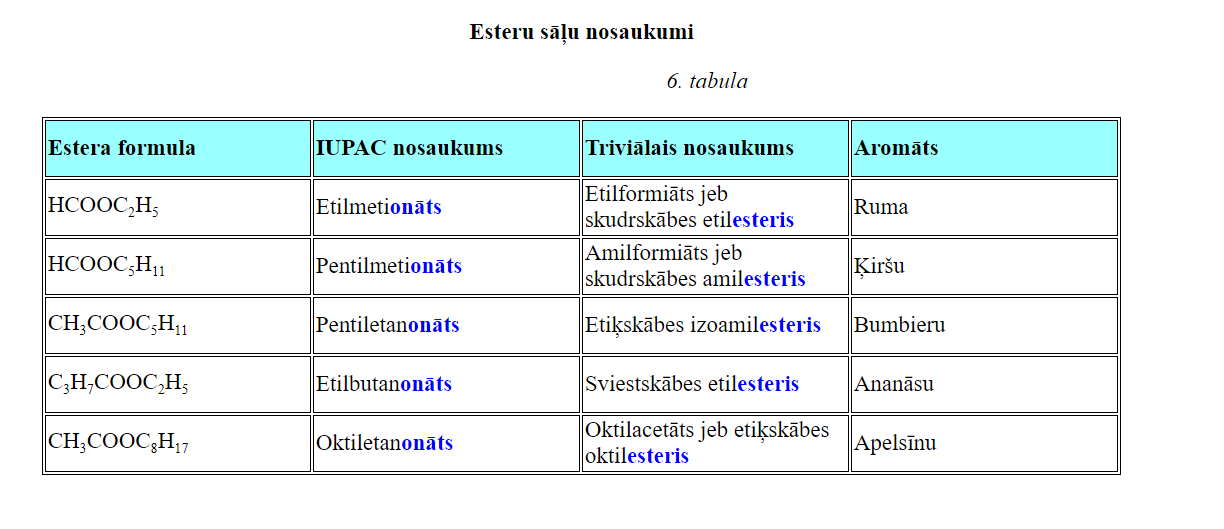
Karbonskābju sāļu nosaukumi

Esteri.
Esteri ir karbonskābju atvasinājumi, kas veidojas esterificēšanās reakcijās, karbonskābēm reaģējot ar spirtiem.
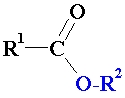
Esteri plaši sastopami dabā. Ziediem augļiem un ogām aromātu galvenokārt piešķir dažādi esteri. Arī tauki un vaski ir esteri. Mūsu dienās daudzus aromātiskos esterus iegūst rūpnieciskajā sintēzē un izmanto pārtikas un parfimērijas rūpniecībā.
Esteru nosaukumus veido:
a) Triviālos nosaukumus
Karbonskābes triviālais nosaukums + spirta alkilgrupas nosaukums + vārds „esteris”
b) IUPAC nosaukumus
Atvasina no skābes nosaukuma ar izskaņu – oāts.
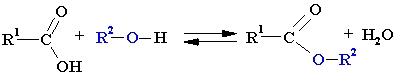
Esteru iegūšana laboratorijā.
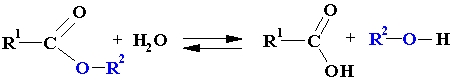
Esteri rodas, skābēm reaģējot ar spirtiem paaugstinātā temperatūrā koncentrētas sērskābes klātbūtnē. Savukārt sārmainā vidē esteri hidrolizējas atpakaļ par spirtu un skābi. Tātad esteru iegūšana un hidrolīze ir apgriezenisks process.
Amīdi.
| Amīdi ir savienojumi, kuru molekulās karboksilgrupas hidroksilgrupa – OH ir aizvietota ar aminogrupu – NH2 | 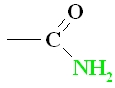 |
Karbonskābju amīdiem ir nozīme ārstniecības vielu (sulfamīdpreparātu) un sintētisko šķiedru (poliamīdu) ražošanā.
Aizvietotās karbonskābes.
Halogēnkarbonskābes – ūdeņraža atoms karbonskābju ogļūdeņraža atlikumā aizvietots ar halogēna atomu.
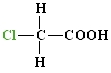
Hidroksikarbonskābes – ūdeņraža atoms karbonskābju ogļūdeņraža atlikumā aizvietots ar hidroksilgrupu.
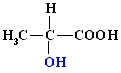
2 – hidroksipropānskābe (pienskābe).
Hidroksiskābes ir izplatītas dabā. Svarīgākās no tām ir pienskābe, vīnskābe un citronskābe.
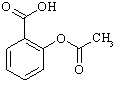
Dabā sastopama arī salicilskābe – kumelīšu un vīgriežu ziedos. No salicilskābe siegūst pretsāpju un temperatūru pazeminošu ārstniecības vielu – aspirīnu.
Aminoskābes – aizvietotas karbonskābes, kuru molekulās ogļūdeņraža atlikumā viens vai vairāki ūdeņraža atomi aizvietoti ar aminogrupu.
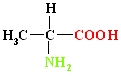
2 – aminopropānskābe (alanīns, Ala).
Aminoskābju –COOH grupai ir skābas īpašības, -NH2 grupai bāziskas īpašības
• Ja aminoskābes molekulā karboksilgrupu skaits ir lielāks par aminogrupu skaitu, tad aminoskābes ūdensšķīduma vide ir skāba,
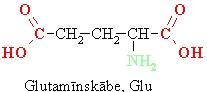
• ja aminogrupu skaits ir lielāks par karboksilgrupu skaitu –bāziska vide,
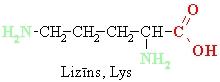
• ja aminogrupu un karboksilgrupu skaits ir vienāds – neitrāla.
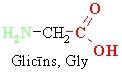
Šķīstot ūdenī, aminoskābes veido bipolārus jonus
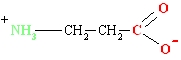
Tāpēc aminoskābes reaģē gan ar skābēm, gan bāzēm, veidojot sāļus.
1. NH2CH2CH2COOH + NaOH → NH2CH2CH2COONa + H2O
2. NH2CH2COOH + HCl → [NH3CH2CH2COOH]Cl
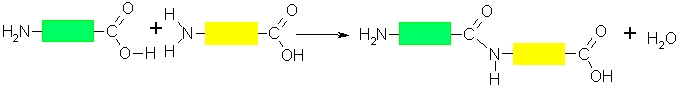
Aminoskābju savstarpējās reakcijās veidojas peptīdi: